신경교세포의 교는 접착의 의미를 지니고 있지만 실제로는 더 많은 역할을 수행합니다. 그 중 소교세포와 성상세포에 대해서 다루어보려 합니다. 왜냐하면 이 교세포들은 시냅스의 연결과 밀접한 관련이 있기 때문입니다.
신경교세포에 대하여서는 아래의 영상 참조부탁드립니다.
미세아교세포(소교세포, 마이크로글리아)는 시냅스를 보체 경로를 통해 포식하여 가지치기 기능을 하며 골수유래 면역세포로 사이토카인과 케모카인에 민감합니다. 사이토카인은 면역세포를 자극하는 호르몬과 같은 물질이며 케모카인은 면역세포들을 유인하고 집합시키는 역할을 합니다.
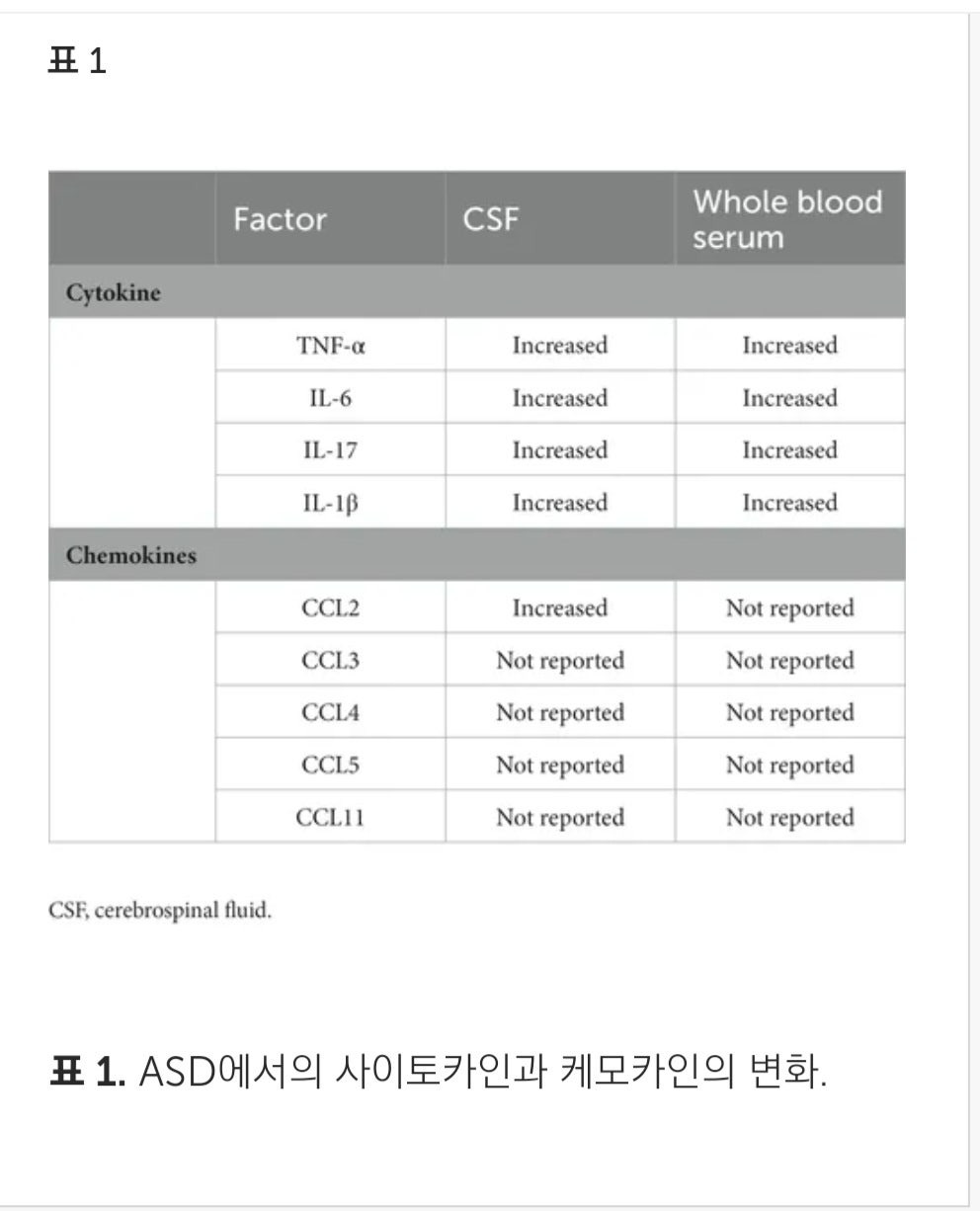
위 표는 ASD환자의 뇌척수액과 혈청에서 증가된 사이토카인과 케모카인의 종류입니다. 미세아교세포가 ASD와 관련이 있다는 간접적인 증거이죠. 그리고 미세아교세포는 선천면역세포로 LPS(지질다당류)와 TLR(톨유사수용체, 세균탐지기)에 민감합니다. 즉 세균에 민감하게 반응하다는 의미입니다. 자극을 받게되면 활성형이 변하게 됩니다.
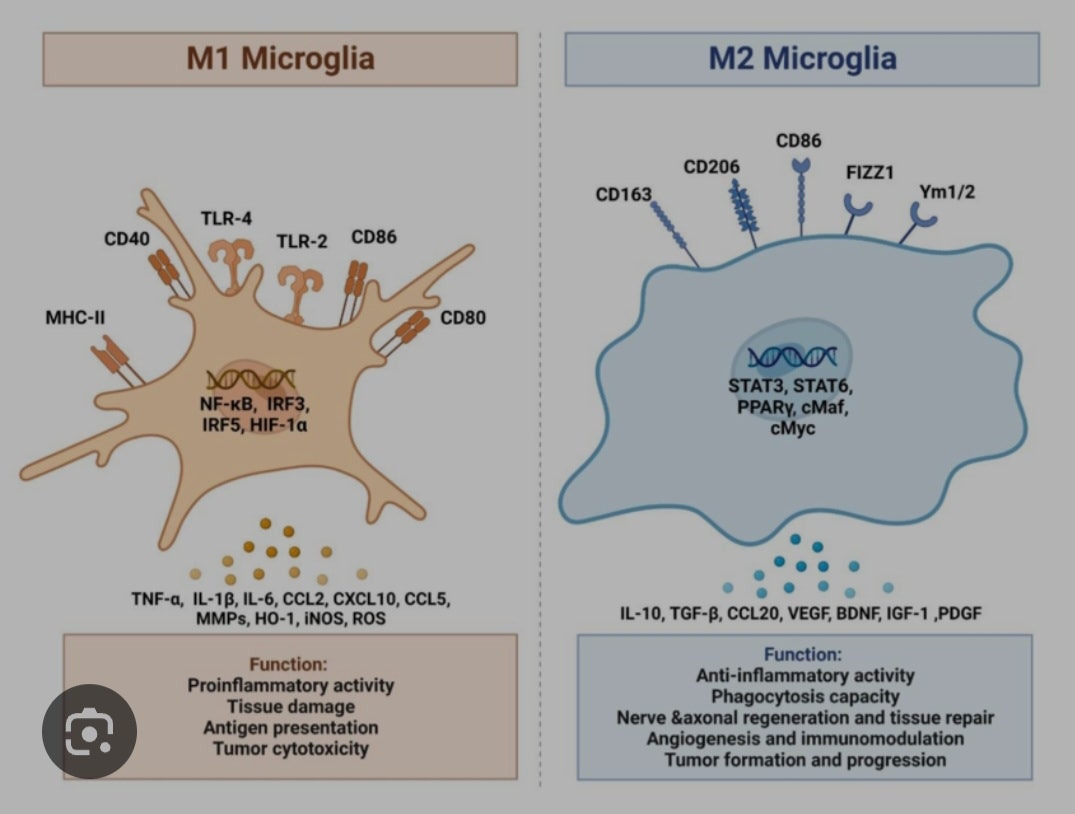
M1, M2형이 받는 자극수용체가 윗부분 가운데는 유전체 아래의 알갱이모양은 생성물질입니다. 쉽게이야기해서 M1은 신경독성, 신경염증에 기여하고 M2는 신경보호, 항염증에 기여합니다. M1형태에서 생성되는 ROS반응산소종은 뇌의 글루타치온을 지속적으로 소모하게 됩니다.
별아교세포(성상세포, 아스트로사이트)는 신경시냅스를 묶어두고 시냅스의 연결을 조정하며 신경전달물질과 이온채널에 영향을 주어 시냅스 항상성에 기여합니다. 또한 뇌혈관을 감싸서 혈뇌장벽을 만들어 뇌로 들어오는 물질들을 엄격히 관리합니다. 별아교세포 또한 활성형이 존재하는데 미세아교세포와 사이토카인과 같은 물질로 소통하며 자극을 받게됩니다.
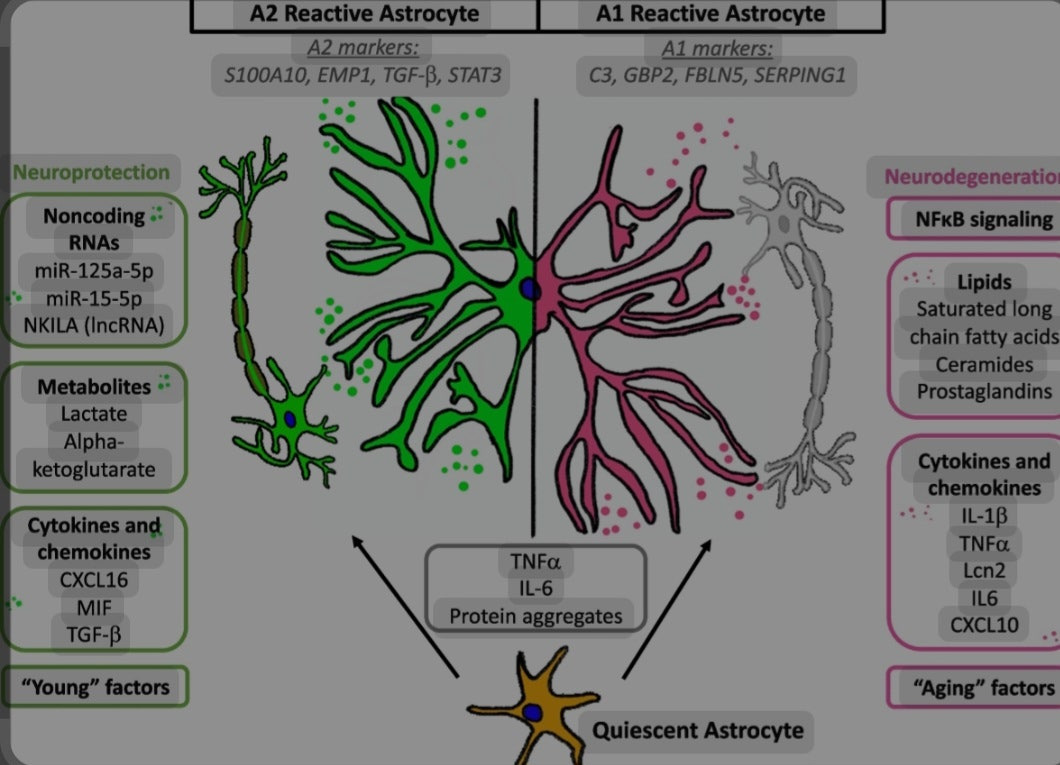
A1은 신경독성, A2는 신경보호 기능으로 미세아교세포의 기능변화와 비슷합니다.
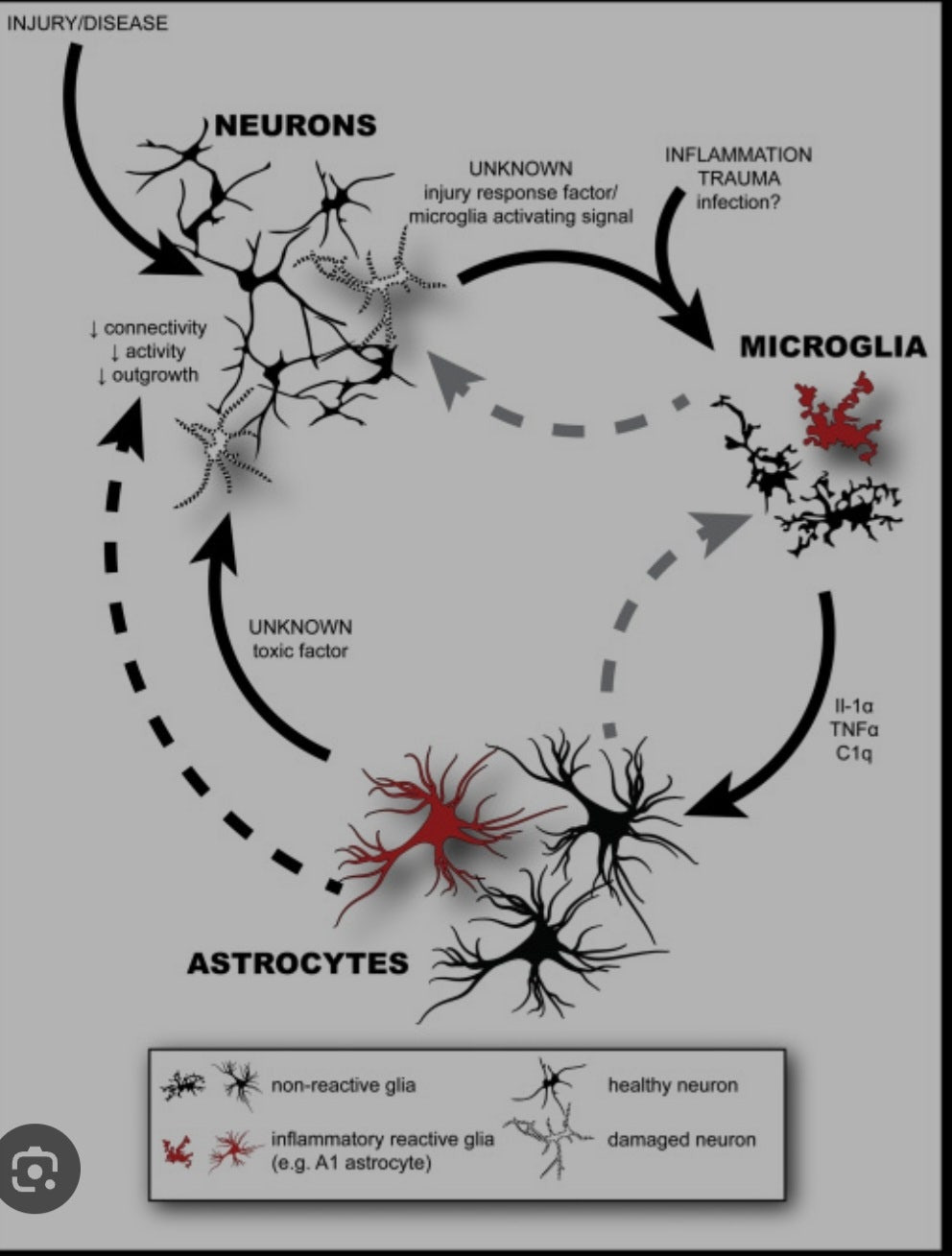
위 그림은 마이크로글리아와 아스트로사이트, 뉴런 시냅스와의 관계를 보여줍니다. 신경염증의 악순환고리이죠. 신경염증으로 인하여 시냅스가지치기가 손상되면 시냅스의 흥분,억제 균형이 깨질 수 있습니다. 흥분시냅스와 억제시냅스의 불균형을 자폐의 원인으로 제기하는 연구들도 있구요.
프론티어 기사에서는 미세아교세포의 조절자로 미토콘드리아와 메틸화를 소개하고 있습니다. 아래는 기사내용 중 일부입니다.
미토콘드리아는 다양한 세포의 요구에 따라 구조와 세포 내 위치가 빠르게 변화하는 역동적인 세포소기관입니다( Ho and Theiss, 2022 ). ASD 환자에서 가장 흔한 대사 장애 중 하나는 비정상적인 미토콘드리아 기능입니다. 최신 연구에 따르면 임신과 초기 생활 동안 미토콘드리아를 통해 매개되는 PM2.5 노출은 ASD 발병 위험을 증가시킬 수 있습니다( Frye et al., 2021a , b ). 임상 역학 연구에서 신경발달 장애에서 미토콘드리아 기능 장애가 입증되었습니다( Thangaraj et al., 2018 ). 증거에 따르면 미토콘드리아 DNA(mtDNA)는 스트레스를 받은 미토콘드리아에서 누출될 때 염증의 주요 활성제입니다( Zhong et al., 2019 ). 게다가 스트레스를 받은 미토콘드리아에서 탈출한 mtDNA는 cGAS-STING 경로 활성화를 통해 염증을 유발하고 산화되면(Ox-mtDNA) 세포질 NLRP3에 결합하여 인플라마좀 활성화를 유발합니다( Xian et al., 2022 ). 피로, 불쾌감, 수면 장애, 인지 문제가 나타나는 근육통성 뇌척수염/만성 피로 증후군(ME/CFS) 환자의 경우, 엑소좀 관련 mtDNA가 인간 미세아교세포가 IL-1β를 방출하도록 자극할 수 있습니다( Tsilioni et al., 2022 ). 게다가 ASD가 있는 어린이의 혈청에서 mtDNA가 유의하게 증가합니다( Theoharides et al., 2013 ). 또한, 포크헤드 박스 P1(FOXP1) 유전자의 반수체 불충분성으로 인한 FOXP1 증후군은 운동 기능 장애, 지적 장애, 언어 장애 및 자폐증으로 나타나는 신경 발달 장애입니다. FOXP1 +/− 마우스에서 미토콘드리아 기능 장애에 대한 새로운 증거는 불충분한 에너지 공급과 과도한 산화 스트레스가 FOXP1 결핍으로 인한 인지 및 운동 장애의 근거임을 시사했습니다( Wang et al., 2022 ). 또한, ASD의 후각 식별 장애는 미토콘드리아 기능 장애와 관련이 있을 수 있습니다( Yang et al., 2022 ). 미토콘드리아는 성상세포 성숙과 시냅스 형성에 관여합니다. 배아 허혈 피질 쥐의 미세아교세포는 햄스터 미토콘드리아를 이식하여 증식할 수 있습니다( Gyllenhammer et al., 2022 ). 따라서 미토콘드리아 기능 장애는 자폐증에서 신경교 세포 이상을 유발하는 데 중요한 역할을 할 수 있습니다.
DNA 메틸화는 ASD에서 특히 관심 있는 분야가 되었습니다( Williams and LaSalle, 2022 ). 자폐증이 있는 아동은 메틸화 장애를 보입니다( Deth et al., 2008 ). 메틸화 장애와 후생유전적 장애는 자폐증에서 흔히 볼 수 있는 면역 기능 장애에 기여합니다( Deth et al., 2008 ). 한 연구에 따르면 차별적으로 메틸화된 영역은 미세아교세포 염증과 미세아교세포 발달을 조절하는 것과 관련된 전사 인자 결합 부위가 풍부한 것으로 나타났습니다( Vogel Ciernia et al., 2018 ). 뇌 세포에서 메틸 CpG 결합 단백질-2(MeCP2) 동형(E1 및 E2)은 중요한 후생유전적 조절자입니다. MeCP2 기능 상실 또는 획득 돌연변이는 ASD, MECP2 복제 증후군, RTT( Lioy et al., 2011 ; Liyanage et al., 2019 )를 포함한 신경 발달 장애를 유발합니다. RTT 및 MECP2 의 동물 모델 연구는 미세아교세포에서 후생유전학적 메커니즘의 오작동을 설명할 수 있습니다. MeCP2는 메틸화된 CG 부위에 결합하여 유전자 전사 조절에 참여합니다. 주요 연구에서는 미세아교세포 특이적 MECP2 녹아웃 마우스에서 RTT와 유사한 표현형이 나타났으며, 이는 야생형 미세아교세포를 보충하면 역전될 수 있음을 보여주었습니다. 또한 미세아교세포에서 MECP2를 삭제하면 세포 외 글루타메이트 수치와 신경 세포 수상돌기에 이상이 발생하는 것으로 나타났습니다. 이 연구에서는 MeCP2가 미세아교세포에서 후생유전학적 기계를 조절하여 마우스 행동에 영향을 미친다는 것을 시사했습니다. 이후 ASD와 관련된 다른 유전자인 OXTR, MAGEL2, SNRPN, RELN 및 GAD1이 ASD 뇌에서 과메틸화된 전사 시작 부위를 갖는 것으로 밝혀져 유전자 생성물의 발현이 감소했습니다( Tremblay and Jiang, 2019 ). 미세아교세포의 정확한 역할은 아직 완전히 정의되지 않았지만 미세아교세포의 후성유전적 조절이 ASD 병인에서 중요한 역할을 한다는 것을 시사하는 증거가 많이 있습니다( Nardone 및 Elliott, 2016 ).
# 제 사견을 말씀드리면 미세아교세포는 선천면역으로 세균에 민감하고.. 신경세포의 미토콘드리아가 염증이나 기능저하로 세포를 자멸시켜 세포 밖으로 누출되면 미세아교세포의 TLR(톨수용체)를 통해 세균으로 잘못인식하여 표현형이 M1으로 바뀌는 계기가 될 수 있지않을까? 생각해봅니다. 신경긴장(NT)이 예민한 우리 자람이들은 스트레스상황에서 혈뇌장벽의 마스트세포가 자극받기 쉽고(마스트셀이 자극받으면 히스타민 분출, 혈뇌장벽 투과성 증가, 사이토카인 전달) 이로인해서 염증이 원인이 될 수 있겠죠.

자세한 내용은 아래의 프론티어 기사를 참조바랍니다.
'자폐증, AUTISM, ASD, 발달장애' 카테고리의 다른 글
| 자폐와 신경가소성: 변화하는 뇌, 그리고 성장의 가능성 (0) | 2025.04.02 |
|---|---|
| 자폐증과 중금속: 몸속 청소 시스템과 건강한 습관 (1) | 2025.04.02 |
| 장내세균과 자폐증의 연관성 (0) | 2025.04.02 |
| 자폐 스펙트럼을 가진 사람들이 어떻게 자신의 강점을 살려 성공했는지 실제 사례를 통해 알아보자! 🚀✨ (0) | 2025.04.01 |
| 지적장애를 동반한 중증 자폐아이와 소통하는 방법🏰 "마법사와 마법 친구 소통 대작전!" 🏰 (0) | 2025.04.01 |



